Witamina D – od ewolucji do epigenetyki. Molekularne podstawy działania hormonu steroidowego
Witamina D, mimo swojej nazwy, reprezentuje w istocie grupę sekosteroidów o aktywności hormonalnej. Jej złożone funkcje biologiczne, kształtowane przez setki milionów lat ewolucji, wykraczają daleko poza klasyczną rolę w homestazie wapniowo-fosforanowej, obejmując regulację immunologiczną, kontrolę proliferacji komórkowej oraz modulację procesów starzenia.
Biosynteza i aktywacja – dwie ścieżki metaboliczne
Endogenna synteza skórna
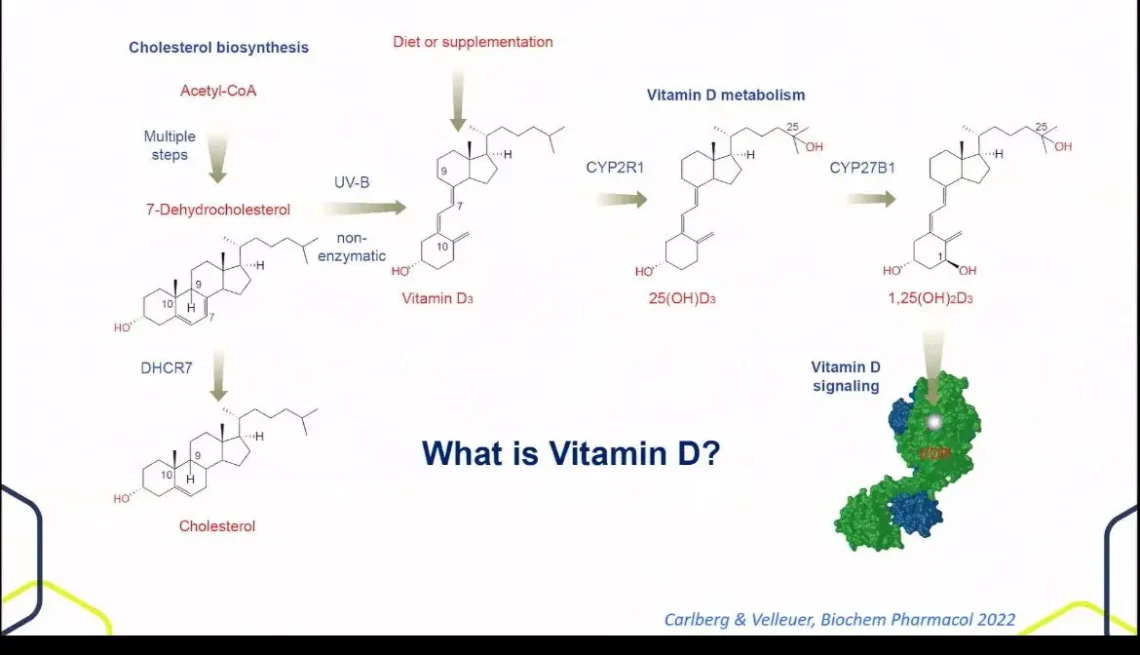
Biosynteza witaminy D³ (cholekalcyferolu) rozpoczyna się od acetylo-CoA, który w wieloetapowym procesie jest przekształcany w 7-dehydrocholesterol. Pod wpływem promieniowania UV-B (290-315 nm) zachodzi nieenzymatyczna fotoliza pierścienia B cząsteczki 7-dehydrocholesterolu, prowadząca do powstania prewitaminy D³, która spontanicznie izomeryzuje do witaminy D³.
Alternatywną ścieżką biosyntezy jest przekształcenie 7-dehydrocholesterolu do cholesterolu przez enzym DHCR7 (7-dehydrocholesterol reduktaza), co ilustruje metaboliczne powiązanie między szlakami syntezy cholesterolu i witaminy D.
Aktywacja metaboliczna
Witamina D³ wymaga dwóch kolejnych hydroksylacji:
- Pierwsza hydroksylacja (wątroba): Enzym CYP2R1 (25-hydroksylaza) katalizuje powstanie 25(OH)D₃ (kalcydiol) – głównej krążącej formy witaminy D, stanowiącej marker jej statusu w organizmie.
- Druga hydroksylacja (nerki/tkanki obwodowe): Enzym CYP27B1 (1α-hydroksylaza) przekształca kalcydiol w aktywną formę 1,25(OH)₂D³ (kalcytriol), będącą ligandem receptora VDR.
Perspektywa ewolucyjna – 600 milionów lat adaptacji funkcjonalnych
Chronologia ewolucyjna systemu witaminy D
Analiza filogenetyczna ujawnia fascynującą historię receptora witaminy D (VDR):
~600 mln lat temu: Pojawienie się pierwszego funkcjonalnego VDR, co poprzedza powstanie kręgowców lądowych o setki milionów lat.
600-400 mln lat temu: Rozwinięcie funkcji związanych z metabolizmem energetycznym i detoksykacją – prawdopodobnie pierwotne role VDR.
400-200 mln lat temu: Ewolucja funkcji immunologicznych:
- Odporność wrodzona (innate immunity)
- Odporność adaptacyjna (adaptive immunity)
200-0 mln lat temu: Adaptacja funkcji specyficznych dla ssaków i naczelnych:
- Homeostaza wapnia
- Przebudowa tkanki kostnej (bone remodeling)
Ten gradient ewolucyjny sugeruje, że regulacja metabolizmu mineralnego jest stosunkowo młodą funkcją witaminy D, podczas gdy jej pierwotne role wiązały się z podstawowymi procesami metabolicznymi i obronnymi.
Kontekst ewolucji człowieka
Interesujące jest, że synteza cholesterolu (substrat dla witaminy D) pojawiła się około 1000 mln lat temu, podczas gdy Homo sapiens opuścił Afrykę zaledwie ~70 000 lat temu (0,07 mln lat temu). Ten krótki okres ewolucyjny prawdopodobnie nie wystarczył do pełnej adaptacji do zmienionej ekspozycji na UV-B w różnych szerokościach geograficznych, co może częściowo wyjaśniać współczesną epidemiologię niedoborów witaminy D.
Mechanizmy molekularne – sygnalizacja genomowa i epigenetyczna
Kompleks receptorowy VDR-RXR
Kalcytriol [1,25(OH)₂D³] działa jako ligand dla receptora VDR (Vitamin D Receptor), należącego do nadrodziny receptorów jądrowych. Po związaniu liganda, VDR tworzy heterodimer z receptorem RXR (Retinoid X Receptor), który następnie wiąże się z elementami odpowiedzi na witaminę D (VDRE – Vitamin D Response Elements) w regionach promotorowych genów docelowych.
Epigenetyczna regulacja ekspresji genów
Kompleks VDR-RXR funkcjonuje jako regulator epigenetyczny, rekrutując:
- „Writers” (pisarze): Acetylo- i metylotransferazy modyfikujące histony
- „Erasers” (kasowniki): Deacetylazy i demetylazy histonów
- „Readers” (czytelnicy): Białka rozpoznające zmodyfikowane histony
Te modyfikacje chromatyny prowadzą do:
- Remodelingu struktury chromatyny
- Zmiany dostępności DNA dla czynników transkrypcyjnych
- Aktywacji lub represji transkrypcji genów docelowych
Geny regulowane przez VDR – szerokie spektrum działania
Genom człowieka zawiera tysiące potencjalnych miejsc wiązania VDR. Do najlepiej scharakteryzowanych genów docelowych należą:
Metabolizm mineralny i funkcje komórkowe:
- CAMP – peptyd przeciwdrobnoustrojowy katelicydyna (↑)
- CYP24A1 – 24-hydroksylaza, enzym katabolizujący witaminę D (↑)
- BGLAP – osteokalcyna (↑)
- PTH – hormon przytarczyc (↓)
Regulacja immunologiczna i transportu jonów:
- CD14 – koreceptor dla lipopolisacharydu (↑)
- TNFSF11 – RANKL, regulator osteoklastogenezy (↑)
- TRPV6 – kanał wapniowy (↑)
Kontrola cyklu komórkowego i wzrostu:
- CDKN1A – inhibitor kinaz zależnych od cyklin p21 (↑)
- MYC – proto-onkogen (↓)
- IGFBP3 – białko wiążące IGF (↑)
- CYP27B1 – 1α-hydroksylaza (↓)
To spektrum genów docelowych, obejmujące zarówno indukcję (↑) jak i represję (↓) transkrypcji, wyjaśnia plejotropowe efekty witaminy D na poziomie fizjologicznym.
Programowanie epigenetyczne komórek immunologicznych
Rola witaminy D w hematopoezie
Podczas różnicowania hematopoetycznych komórek macierzystych (HSC) do dojrzałych komórek krwi, witamina D odgrywa kluczową rolę w determinacji linii mieloidalnej poprzez interakcję z czynnikami transkrypcyjnymi PU.1 i CEBPα.
Linia mieloidalna (pod wpływem VDR/PU.1/CEBPα):
- Monocyty → Makrofagi
- Monocyty → Komórki dendrytyczne
- Granulocyty (eozynofile, neutrofile, bazofile)
- Erytrócyty i płytki krwi
Linia limfoidalna:
- Limfocyty B
- Limfocyty T
- Komórki NK (natural killers)
- ILC (Innate Lymphoid Cells)
- PBMC (Peripheral Blood Mononuclear Cells)
Badania in vivo potwierdzają, że witamina D i VDR uczestniczą w epigenetycznym programowaniu tych komórek podczas hematopoezy, co ma bezpośrednie konsekwencje dla funkcjonowania układu odpornościowego.
Witamina D a trajektoria starzenia biologicznego
Rozbieżność między wiekiem chronologicznym a biologicznym
Współczesna gerontologia rozróżnia:
- Wiek chronologiczny: Czas, który upłynął od narodzin
- Wiek biologiczny: Rzeczywisty stan fizjologiczny organizmu
Interindywidualna wariancja w starzeniu biologicznym jest znaczna. Przy tym samym wieku chronologicznym (na przykład ~70 lat), różni osobnicy mogą znajdować się na różnych trajektoriach:
Trajektoria optymalna (niski wiek biologiczny):
- Niskie ryzyko chorób niezakaźnych (NCDs)
- Determinowana przez: dobry sen, zdrową dietę, aktywność fizyczną, interakcje społeczne
Trajektoria suboptymalna i nieoptymalna:
- Wysokie ryzyko NCDs
- Determinowana przez: niekorzystny styl życia, czynniki środowiskowe, genetyczne predyspozycje
Rola witaminy D w modulacji starzenia
Chociaż dane są wciąż gromadzone, dowody sugerują, że odpowiedni status witaminy D może wspierać:
- Optymalną trajektorię starzenia biologicznego
- Redukcję stresu oksydacyjnego
- Modulację procesów zapalnych (inflammaging)
- Utrzymanie funkcji immunologicznych (immunosenescence)
Mechanistycznie może to wynikać z epigenetycznej regulacji genów zaangażowanych w odpowiedź na stres, naprawę DNA i kontrolę cyklu komórkowego.
Implikacje kliniczne i badawcze
Zrozumienie molekularnych podstaw działania witaminy D otwiera nowe perspektywy:
- Medycyna personalizowana: Polimorfizmy genów VDR, CYP2R1, CYP27B1 mogą wpływać na indywidualną odpowiedź na suplementację.
- Modulacja epigenetyczna: Witamina D może być narzędziem epigenetycznego przeprogramowania w kontekście chorób autoimmunologicznych i nowotworowych.
- Interwencje anti-aging: Optymalizacja statusu witaminy D jako element strategii spowolnienia starzenia biologicznego.
Podsumowanie
Witamina D stanowi ewolucyjnie konserwowany system sygnalizacyjny o fundamentalnym znaczeniu dla homeostazy organizmów kręgowych. Jej mechanizm działania, oparty na epigenetycznej regulacji ekspresji genów poprzez kompleks VDR-RXR, pozwala na koordynację procesów metabolicznych, immunologicznych i proliferacyjnych.
Perspektywa ewolucyjna pokazuje, że funkcje związane z metabolizmem wapnia są stosunkowo młode, podczas gdy pierwotne role witaminy D obejmowały podstawowe procesy metaboliczne i obronne. Współczesne badania ujawniają jej potencjał w kontekście modulacji starzenia biologicznego i prewencji chorób przewlekłych, co czyni ją przedmiotem intensywnych badań translacyjnych.
Bibliografia:
- Carlberg & Velleuer, Biochemical Pharmacology 2022
- Carlberg & Velleuer, Nutrients 2024
- Maestro, Molnár & Carlberg, Journal of Medicinal Chemistry 2019
- Carlberg et al., npj Aging 2025
- Carlberg, Nutrients 2022
Zobacz również

Życzenia świąteczne
23 grudnia 2019
Przyprawy wzmacniające smak ważyw
9 lutego 2023

